Computer berechnen Umgestaltung von Mikroorganismen zu Zellfabriken
Forschungsbericht (importiert) 2017 - Max-Planck-Institut für Dynamik komplexer technischer Systeme
Mikroorganismen können ein breites Spektrum an Chemikalien und Biokraftstoffen synthetisieren und gewinnen in einer stärker biobasierten Industrie immer weiter an Bedeutung. Oftmals produzieren die Zellen die gewünschten Substanzen allerdings nicht von allein oder nicht effizient genug und müssen daher durch geeignete genetische Eingriffe im Stoffwechsel zu Hochleistungsproduzenten umfunktioniert werden.
Der Stoffwechsel (Metabolismus) selbst eines recht einfachen Mikroorganismus ist hochgradig komplex und umfasst in der Regel Hunderte oder gar Tausende Metabolite (wie Zucker oder organische Säuren) und biochemische Reaktionen. Um im Labyrinth der sich daraus ergebenden Stoffwechselnetzwerke nicht den Überblick zu verlieren, verwenden Wissenschaftler neben Laborexperimenten verstärkt mathematische Modelle und Computersimulationen. Diese helfen unter anderem bei der Suche nach Kombinationen von genetischen Eingriffen, die eine normale Zelle in eine biochemische Fabrik zur Synthese eines gewünschten Produktes umwandeln.
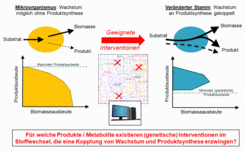
Abb.1: Das Prinzip der Kopplung von Wachstum und Produktsynthese in mikrobiellen Produktionsorganismen.
Im Idealfall lässt sich dabei das Wachstum der Zelle obligatorisch mit der Synthese des Produkts koppeln (Abb. 1). Die Zelle kann sich dann nämlich nur noch vermehren, wenn die gewünschte Chemikalie als Nebenprodukt entsteht. Eine solche Kopplung läuft zum Beispiel in natürlicher Art und Weise ab, wenn Hefen unter Sauerstoffausschluss das Gärprodukt Alkohol produzieren (müssen). Da Mikroorganismen gewöhnlich immer nach maximalem Wachstum streben, vereinen die Ingenieure dadurch geschickt ihre Interessen mit denen des Lebewesens.
Für ausgewählte Produkte konnte in früheren Arbeiten von verschiedenen Forschungsgruppen nachgewiesen werden, dass eine solche Kopplung erzwungen werden kann. Bisher war aber unklar, inwieweit sich ein solches Designprinzip auf ein breites Spektrum von anderen Produktklassen und für verschiedene Mikroorganismen verallgemeinern und anwenden lässt..
Wachstumsgekoppelte Überproduktion ist fast universell möglich
Dieser Frage sind nun Wissenschaftler der Arbeitsgruppe Analyse und Redesign biologischer Netzwerke am Max-Planck-Institut für Dynamik komplexer technischer Systeme in Magdeburg unter der Leitung von Steffen Klamt auf den Grund gegangen. Sie untersuchten für fünf der wichtigsten biotechnologischen Produktionsorganismen, für welche Metabolite eine mit Wachstum gekoppelte Synthese möglich ist. Zu den analysierten Produktionsorganismen gehörten sowohl klassische „Arbeitspferde“ der Biotechnologie wie Escherichia coli und Bäckerhefe als auch beispielsweise photosynthetische Bakterien.
Für die aufwändigen Berechnungen entwickelten sie zunächst effiziente Algorithmen, die in mathematischen Modellen der Stoffwechselnetze Angriffspunkte zum Erzwingen einer solchen Kopplung aufspüren. Als zentrales und zugleich überraschendes Ergebnis konnten die Forscher damit zeigen, dass sich für fast jeden Metaboliten (mehr als 94 %) in den fünf Modellorganismen eine Interventionsstrategie finden lässt, die Wachstum an eine Überproduktion des Metaboliten mit einer guten Ausbeute erzwingt.
Die fünf Organismen decken ein breites Spektrum von relevanten Produkten für die chemische Industrie ab. Dazu zählen Biokraftstoffe, Biopolymere, Nahrungsergänzungsmittel oder Plattformchemikalien zur Synthese anderer Substanzen. Somit sind diese Ergebnisse [1] von weitreichender Bedeutung für die Entwicklung neuer biotechnologischer Prozesse.
Anwendungsbeispiel: Umgestaltung von E. coli zum Itaconsäureproduzenten
Unter Anwendung beschriebenen Kopplungsstrategie hat die Gruppe in einer Parallelstudie einen Stamm des Bakteriums Escherichia coli erfolgreich so verändert, dass dieser Itaconsäure, eine wichtige Plattformchemikalie, mit bisher unerreichter Ausbeute aus Traubenzucker produziert [2]. Zunächst einmal musste dazu das Gen für die cis-Aconitat-Decarboxylase aus einem anderen Organismus (Aspergillus terreus; ein pilzartiger natürlicher Produzent von Itaconsäure) in E. coli eingebracht werden. E. coli besitzt dieses Enzym, das den letzten Schritt der Itaconsäuresynthese katalysiert, nicht und kann daher Itaconsäure im Wildtypen nicht produzieren. Danach suchten die Wissenschaftler mit Hilfe eines Stoffwechselmodells von E. coli nach Kombinationen von genetischen Eingriffen, die zur wachstumsgekoppelten Synthese von Itaconsäure führen.
Zur Berechnung der möglichen Interventionsstrategien wurden Algorithmen aus einer speziell entwickelten Software (CellNetAnalyzer) verwendet (Abbildung 2) [3]. Eine dieser Strategien wurde ausgesucht und im Labor in E. coli umgesetzt: fünf vom Algorithmus vorgeschlagene metabolische Gene wurden entfernt, wodurch bestimmte Stoffwechselwege in E. coli blockiert wurden. Dadurch konnte der konstruierte Stamm wie gewünscht nur noch wachsen, wenn dieser Itaconsäure in größeren Mengen als Nebenprodukt synthetisiert: 68 % der eingesetzten Glukose landeten im Produkt. Dieses konkrete Anwendungsbeispiel hat das Potenzial der Kopplungsstrategie nochmals nachhaltig demonstriert..
Weitergehende Forschung gefördert durch den ERC
Für weitere Forschungen zur computergestützten Optimierung des Stoffwechsels von Mikroorganismen wird die Gruppe um Steffen Klamt von 2017 bis 2022 mit zwei Millionen Euro im Rahmen eines Consolidator Grants des Europäischen Forschungsrats (European Research Council, ERC) gefördert. Das StrainBooster-Projekt zielt auf ein erweitertes Designprinzip für mikrobielle Produktionsorganismen ab. Hierbei sollen gezielte Manipulationen im Energiestoffwechsel die Produktsynthese nicht nur mit hoher Ausbeute (pro Substrat), sondern auch mit hoher Rate (pro Zeiteinheit) optimieren..

